Contiene sulfitos, advertencia que vemos en la mayoría de etiquetas de las botellas de vino. Pero, ¿qué son los sulfitos? Los sulfitos son productos que se utilizan fundamentalmente como fungicidas y bactericidas, es decir para impedir el crecimiento de hongos y bacterias, pero también como antioxidantes.
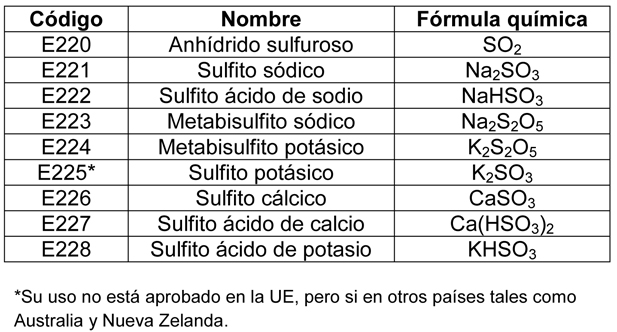
Al grupo de los nueve aditivos alimentarios con la calificación de conservantes alimentarios que van desde el código E-220 al E-228,derivados del azufre, se les denomina “sulfitos” (Tabla1).
El hecho de adicionar sustancias ajenas al vino, para determinadas personas poco documentadas, inquieta, las considera nocivas y afirman que se añade “química” al vino. Quiero recordar que por definiciónla Química “es la ciencia que estudia la materia y sus transformaciones”, por lo tanto todo lo que es materia y trasformación de la misma, es química,es decir, el vino es un típico producto químico, así como lo es la leche,el queso,el pan, el aceite, etc.
La adición de determinados compuestos al vino resulta de suma importancia en la elaboración de vinos de calidad, ya que ayuda a llevar a cabo de forma segura los procesos enológicos impidiendo alteraciones por bacterias, hongos u oxidaciones, garantizando la calidad del vino. Si bien es cierto que determinados enólogos no usan sulfitos, lo que puede ser loable, pero no deberíansostener que son vinos sin química, porque están haciendo transformaciones de la materia y eso es química.
Que sean sustancias procedentes del azufre las que se añaden, no nos suele sonar bien, pero no son para nada malos aditivos, o mejor dicho, no son los peores aditivos. No solo los encontramos en el vino, sino también en productos fermentados tales como la cerveza o el pan en donde se producen de forma natural.
El sulfito que se suele añadir al vino es el anhídrido sulfuroso, SO2, también conocido como dióxido de azufre, óxido sulfuroso o simplemente sulfuroso, (código E-220), aunque también es ampliamente utilizado otro donador de anhídrido sulfuroso, el metabisulfito potásico K2S2O5 (código E-224).
Hay que tener en cuenta que el anhídrido sulfuroso y el ácido sulfhídrico, SH2, son productos que aparecen en el vino de forma natural en pequeña cantidad, debido a que son producidos por las levaduras a partir de los aminoácidos azufrados: cistina, cisteína y metionina. Los sulfitos también los encontramos en otros alimentos a los que se han añadido para mantener el color, sabor o como conservantes, tales como son los crustáceos (gambas, langostinos, camarones,…), salchichas, pescados, frutos secos o zumos. Su efecto sobre estos productos es antioxidante, ya que inhibe el oscurecimiento producido por ciertas enzimas propias de estos alimentos.
Algunos datos históricos sobre el azufre y sulfuroso
El anhídrido sulfuroso se puede obtener quemando azufre y el metabisulfito potásico haciendo burbujear el sulfuroso en una disolución de hidróxido potásico y/o carbonato potásico. Téngase en cuenta que sulfuroso deriva etimológicamente del latín “sulfur” que significa «piedra que quema».
El azufre inhibe determinados procesos metabólicos que producen efectos irreversibles sobre los patógenos: Inhibe la síntesis de ácidos nucleicos y proteínas, así como bloquea la respiración celular. Además el azufre sufre una lenta oxidación en presencia de aire húmedo produciendo anhídrido sulfuroso, ácido sulfhídrico, ácido sulfúrico, polisulfuros y ácidos politiónicos.
Una de las primeras referencias sobre el azufre la encontramos en la Biblia, concretamente en el Génesis (Gen 19, 4), referida a la destrucción de Sodoma y Gomorra: “Entonces Yavé hizo llover sobre Sodoma y Gomorra azufre…”. El azufre ya se utilizaba en la antigua Grecia para esterilizar la ropa de los enfermos,se le atribuía propiedades medicinales y se empleabapara el blanqueamiento de telas. Los griegos exponían las ropas que querían desinfectar al sol y espolvoreaban azufre sobre ellas, el sol al calentar el azufre desprendía pequeñas cantidades de anhídrido sulfuroso que era suficiente para esterilizarlas. También los egipcios utilizaban el anhídrido sulfuroso para purificar el aire de sus templos. En la Roma clásica empezó a utilizarse para la plagas de hongos de las vides y probablemente en la conservación de algunos vinos, y desde el siglo XVII con gran probabilidad para conservar la sidra.
En la época de Pirro de Epiro, durante las Guerras Pírricas (280-275 a. C), en Sicilia se relatan yacimientos de cristales de azufre provenientes del volcán Etna. Los alquimistas consideraban que el azufre era el componente que faltaba en la piedra filosofal para poder fabricar oro artificial. Antoine de Lavoisier en el año 1777 descubrió que el azufre era un elemento químico en lugar de un compuesto.
El azufre libre se encuentra en depósitos volcánicos, aguas termales y también en yacimientos subterráneos, abunda en Estados Unidos (Texas y Luisiana), Sicilia, México, Arabia Saudí, Polonia y España. En estado combinado aparece en forma de sulfuros (pirita y galena) y sulfatos (yeso), en numerosos minerales, incluido el petróleo. También se encuentra en gran variedad de compuestos orgánicos,tales como proteínas animales y vegetales.
La historia económica y social de la isla de Sicilia de los dos últimos siglos está íntimamente relacionada con el azufre, su auge se debe a la utilización para la fabricación de pólvora negra y cerillas. La pólvora negra tiene entre sus componentesentre un 10 y un 15% de azufre, aparte de carbón y nitrato de potasio. En Sicilia se crearon pueblos, sólo para trabajar en las minas y a partir del siglo XVIII se estableció en la isla una industria relacionada con la extracción de azufre. Durante el reinado de Fernando II de las Dos Sicilias, Sicilia tenía el monopolio de la producción mundial de azufre (“zolfo” en italiano). A partir de 1845 con la llegada a Europa del oídio procedente de América aumentó la demanda para el uso de la agricultura, para combatir los ataques de este hongo en la vid y otros frutales. En 1905 el 91% de la producción mundial de azufre procedía de Sicilia. Para facilitar su transporte y comercialización el azufre nativo ese transformaba en bloques de azufre purificado. La forma de hacer esta transformación era apilar la mena del azufre que se prendía en hornos en pendiente, a medida el azufre se quemaba, fundía, fluía por la pendiente y se recogía en bandejas de madera donde se enfriaba. Los efectos nocivos para la salud y la mortalidad de los trabajadores delas minas sicilianas eran altísimos. Por otra parte, era tremendamente inhumano utilizar niños en estas labores, los llamados “carusi”, que eran forzados a trabajar durante largas jornadas y a menudo morían por los derrumbes, en unos yacimientos mal acondicionados. El líder de la comunidad negra estadounidense, Booker Taliaferro Washington, que había sido liberado de la esclavitud en su infancia, decía: “Una mina de azufre en Sicilia es lo más parecido al infierno», de hecho, en Sicilia se decía que el azufre era “el oro del diablo”. El cuadro de Renato Guttuso, “La zolfara”, es una conmovedora representación del arduo trabajo de estos mineros en las minas sicilianas. (Figura 1).

El declive del azufre siciliano empezó cuando se descubren en 1906 las minas americanas de Louisiana y Texas que tenían una mayor facilidad para la extracción y menos costos que el siciliano. El método de extracción del azufre americano consistía en inyectar en las profundidades vapor de agua sobrecalentado el cual, debido a la baja temperatura de fusión del azufre (119º C), lo funde bajo tierra y lo empuja en estado líquido hacia la superficie.
La producción de azufre tuvo su apogeo durante la Primera Guerra Mundial ya que aumentó la demanda con fines bélicos. Hoy en día el azufre, fundamentalmente, se obtiene como un subproducto de la industria petroquímica, y pocas explotaciones se dedican a sacar el azufre de la tierra, excepto algunos javaneses que todavía lo recogen en un volcán activo. El petróleo, el gas natural y el carbón contienen azufre. Estos productos se denominan “ácidos”, cuando arden producen anhídrido sulfuroso, SO2, que se libera a la atmósfera, este puede combinarse con otro átomo de oxígeno formando el trióxido de azufre (SO3) que en contacto con la humedad atmosférica se convierte ácido sulfúrico (H2SO4), el cual al precipitar sobre la superficie forma lo que denominamos “lluvia ácida”, muy nociva para el medio ambiente.
Las personas más mayores recordaréis que en la década de los años 70 del siglo pasado, una de las primeras crisis que afectaron al medio ambiente fue la causada por la lluvia ácida que afectaba a los acuíferos, hacia desaparecer la vegetación y dañaba los monumentos y estatuas. La lluvia ácida tuvo como consecuencia la aprobación de leyes que obligaba a las compañías energéticas a reducir sus emisiones de anhídrido sulfuroso. Para solucionar estas emisiones, por una parte se dejó de usar las fuentes de combustible más ricas en azufre, tales como el carbón, y por otra se extrajo el azufre antes de quemarlo. Actualmente más de la mitad del azufre que se utiliza a nivel mundial se obtiene por desulfuración del petróleo o delgas natural. Este hecho ha contribuido en la bajada del precio y de que existan grandes excedencias de azufre. En la zona petrolífera de la provincia canadiense de Alberta impresiona ver los residuos de arenas bituminosas de azufre que se han ido acumulando. Al no poderse transportar de una forma que resulte económica a los mercados se va acumulando en bloques de miles de toneladas, (Figura 2).

En Oriente Medio y en especial en Abu Dabi, se está produciendo más azufre del que se puede utilizar. Al ser la demanda inferior a la producción este azufre termina también en bloques. Sin embargo el exceso de azufre que disponemos hoy en día no durará para siempre. El petróleo y gas natural ácido se acabará o dejaremos de explotarlos, porque pasaremos a utilizar fuentes de energía alternativas más limpias y probablemente más baratas, entonces será cuando volvamos a echar mano de estos bloques de azufre acumulados.
Fuentes de anhídrido sulfuroso y derivados
Tanto el anhídrido sulfuroso como el metabisulfito se pueden obtener fácilmente a partir del azufre y sulfuros.
La combustión de azufre se utiliza como fuente de anhídrido sulfuroso, el azufre se combina con el oxígeno rindiendo dióxido de azufre:
S + O2 → SO2
Cuando se utiliza este proceso una parte del azufre suele sublimar y pasar al vino. También, tiene el inconveniente de la formación de pequeñas cantidades de ácido sulfhídrico y mercaptanos que dan mal olor y sabor. El gas obtenido así puede llegar a alcanzar hasta un 6-8% de anhídrido sulfúrico. La utilización de este procedimiento de obtención de dióxido de azufre suele estar reservado fundamentalmente para el sulfitado de recipientes y barricas de roble.
Actualmente se encuentra comercializado el anhidro sulfuroso comprimido en balas, realmente se trata de sulfuroso licuado por presión, se licúa a -15˚C a presión normal, o a una presión de tres atmosferas a 15˚C. Este sulfuroso procede de la tostación controlada de azufre y/o sulfuros. El anhídrido sulfuroso se disuelve fácilmente en agua. Se puede preparar haciendo burbujear lentamente SO2 en agua (5 Kg en 100 L de agua). Esta solución acuosa se conserva sin riesgo de oxidación apreciable durante de 5 a 6 días.
El metabisulfito que se emplea es el de potasio, K2S2O5, por su mayor estabilidad frente al de sódico, además, el metabisulfito sódico es una sal fácil de alterar en presencia de aire porque produce la pérdida espontánea de SO2 y el tránsito a sulfato. Frente a la humedad, el metabisulfito potásico cambia muy poco y en disolución es unas 20 veces menos oxidable que el sódico. El metabisulfito potásico se puede obtener tratando una disolución de hidróxido potásico y/o carbonato potásico con anhídrido sulfuroso.
2 SO2 + 2 KOH → K2S2O5 + H2O
El sistema de recurrir a las sales cristalizadas de riqueza conocida para generar anhídrido sulfurososuele ser más recomendable porque permite regular de forma fiable su concentración y hacerlo correctamente por personal menos especializado. El metabisulfito cuando está en disolución es un generador de iones bisulfito, HSO3–, en virtud de la ecuación:
S2O5= + H2O -> 2HS03–
por lo que su empleo equivale al de este último, con la ventaja de su mayor concentración por unidad de peso.
Algunas propiedades del anhídrido sulfuroso
El anhídrido sulfuroso, SO2 es un gas incoloro. Es más pesado que el aire (densidad doble que la del aire, en condiciones normales) por lo que se propaga a ras del suelo.Es incoloro pero si hay humedad en el ambiente forma una especie de niebla.Su olor es picante e irritante“similar al de una cerilla recién encendida”, penetrante, sofocante y asfixiante. El olor del SO2 es perceptible a muy bajas concentraciones, según la sensibilidad olfativa de cada persona, normalmente se percibe en niveles comprendidos entre 0.3 y 1.4 partes por millón (ppm) y a concentraciones superiores a 3 ppm es muy notable. Hay estudios que han observado un umbral de detección por elolfato humanodel SO2 llegar a 1 mg/m³.
La forma molecular, SO2 o SO3H2, es la que posee las propiedades antioxidante y antiséptica. El anhídrido sulfuroso libre del vino actúa como reductor pudiéndose asociar al oxigeno formando ácido sulfúrico e impidiendo su oxidación.
SO3˭+ O2 → SO4˭.
La forma no disociada esla principal responsable de la actividad antimicrobiana, con respecto al bisulfito es unas 500 veces más efectivo a la hora de inhibir bacterias y unas 20 veces más efectivo para inhibir levaduras. En el rango del pH del vino 2,8-4,2 esta forma se encuentra en bajas concentraciones. Cuanto menor sea el pH del vino, mayor será la concentración de anhídrido sulfurosoen la forma activa, pero también el responsable del indeseable olor picante. El anhídrido sulfuroso combinado, presenta una pequeña actividad inhibitoria de algunos géneros de bacterias, principalmente sobre las lácticas, posiblemente consecuencia de la capacidad que tienen estas bacterias de utilizar como fuente de energía la molécula que esta combinada con el anhídrido sulfuroso,de esta forma se libera el SO2 que estaba combinado, quedando en su forma libre y por tanto puede ejercer su acción bactericida.
Salud y ácido sulfuroso
El sulfuroso destruye la vitamina B1, la tiamina, pero el vino no es fuente de esa vitamina, por lo que solo tiene importancia en alimentos ricos en tiamina como es la carne. El sulfuroso tiene la propiedad de proteger en cierto grado a la vitamina C, el ácido ascórbico, pero en el vino esta propiedad no es relevante ya que tampoco se encuentra presente esta vitamina.
En nuestro organismo, sin ingerirlos, los sulfitos circulan en sangre en concentración que oscilan entre indetectable hasta 10 micromolar (mM). Proceden del metabolismo de los aminoácidos azufrados, cistina, cisteína y metionina, siendo el compuesto intermedio en su transformación a sulfatos. Cuando una persona sana ingiere sulfitos de forma oral aparece al cabo de 30 minutos un pico de concentración en sangre de alrededor 100 mM, sin que se observe efecto adverso alguno, al cabo de pocas horas se recuperan los valores normales. La mayor parte del aclaramiento delos sulfitos se debe a la acción de la enzima mitocondrial denominada sulfito oxidasa, que se encuentra presente en casi todos los tejidos, – hígado, riñón, y corazón- la cual trasforma este compuesto a sulfato (Figura 3).
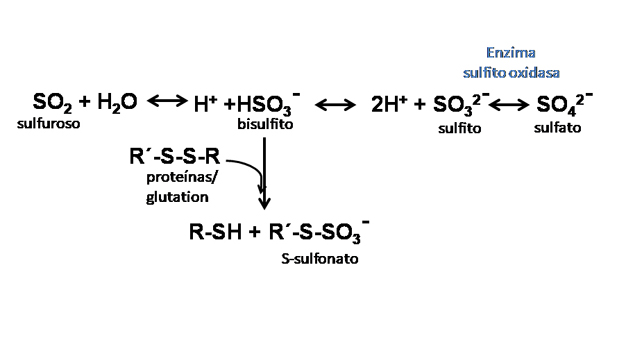
Esta enzima tiene como cofactor una molibdopterina, un cofactor conmolibdeno (MoCo). Los iones bisulfito pueden reaccionan con los puentes disulfuro de las proteínas para formar S-sulfonatos y también como con el glutatión oxidado formando glutation S-sulfonato, prolongando la presencia de SO2 en el organismo. Los S-sulfonatos circulantes se descomponen lentamente a SO2 o sulfatos. El anhídrido sulfuroso es exhalado en parte, mientras que los sulfatos pasan a formar parte del “pool” endógeno del sulfato. Estos sulfatos son lentamente eliminados desde la sangre a través de la orina.
En seres humanos se ha descrito la rara deficiencia congénita de sulfito oxidasa. Esta enfermedad es muy poco común, se conocen solo alrededor 100 pacientes con deficiencia de sulfito oxidasa a nivel mundial, y aproximadamente el 75% de los casos están relacionados con un déficit del cofactor, MoCo. Estos pacientes desarrollan graves anomalías neurológicas que provocan la muerte en etapas tempranas de la vida. Es probable que el daño cerebral que produce esta patología sea el resultado de la acumulación de sulfitos hasta niveles tóxicos, que causan desmielinización y pérdida de gran cantidad de neuronas. Sin embargo, en personas sanas, los niveles intracelulares de sulfitos se mantienen bajos. Se ha sugerido que una baja actividad de esta enzima en algunos individuos puede causar una excesiva acumulación de bisulfito, produciendo una broncoconstricción mediada por colinérgicos.
Entre los asmáticos existe un pequeño porcentaje,entre el 3 y el 8%, que son sensibles a los sulfitos. Para estas personas asmáticas es suficiente los niveles de sulfitos presentes es el vino o en otros alimentos para producirles exacerbación del asma, por lo que deben evitar estos alimentos.
La diarrea y manifestaciones cutáneas que se observan en algunos casos tras la ingesta de sulfitos se ha atribuido a individuos que su jugo gástrico es poco ácido. El anhídrido sulfuroso SO2 inhalado en altas dosis puede causar irritaciones y opresión pulmonar. Lógicamente, también el exceso en el vino altera las características gustativas y olfativas.Por último, señalar que no se ha observado efectos teratógenos, ni cancerígenos asociados al consumo de sulfitos.Hay que resaltar que solo un porcentaje muy pequeño de la población es alérgica a los sulfitos.
Por las razones anteriormente expuestas es por lo que los sulfitos son de declaración obligatoria, la Directiva Comunitaria 2003/89/CE obliga a que conste en la etiqueta de las botellas de vino esta advertencia, “Contiene Sulfitos”, cuando se encuentre en concentraciones de más de 10 mg/litro o lo que equivale, aproximadamente, a 10 partes por millón (ppm). Un vino puede contener una cantidad de SO2 total de hasta 20 mg/l (20 ppm) sin que se la hayan añadido sulfitos, y en este caso está permitido indicar“contiene sulfitos no añadidos”.
La Comisión del Codex Alimentarius, un órgano intergubernamental conjunto de la FAO y la OMS, estipula la Ingesta Diaria Admisible (IDA) de sulfitos es de 0,7 mg por kg de peso corporal. Lo que equivale a 49 mg al día para una persona de 70 kg de peso. Sin embargo, hay que señalar que esa dosis es de nivel de seguridad de 100, es decir, que la cantidad a la cual empiezan a manifestarse los efectos adversos para la salud es 100 veces superior a la IDA.
Los límites del contenido de anhídrido sulfuroso de los distintos tipos de vinos se pueden consultar en el Reglamento Delegado (UE) 2019/934 de la Comisión de 12 de marzo de 2019 que se encuentra en https://www.boe.es/doue/2019/149/L00001-00052.pdf
Fuentes consultadas
1. Jackson, D.I. and Lombard, P.B. Environmental and management practices affecting grape composition and wine quality – A review. Am. J Enology and Viticulture, 1993; 44:409-430.
2. UK Food Standards Agency: «Current EU approved additives and their E Numbers».https://www.food.gov.uk/business-guidance/approved-additives-and-e-numbers
3. Ignacio Herrera Josep A. Visita al Museo Mineralógico, Paleontológico e della Zolfara ‘Sebastiano Mottura’, Caltanissetta, Sicilia, Italia. Paragénesis 2019-1: vol. II, núm. 1 págs. 58-70.
4. Guzman G y Serrano A. Posibilidades del Metabisulfito Potásico en la Industria Conservera. Centro de Investigación de Frutos y Conservas. Universidad de Murcia y Patronato «Juan de la Cierva» 1962.
5. Barcenilla Moraleda, José María. Influencia de las levaduras en los procesos de fermentación y conservación de vinos blancos sobre polifenoles, polialcoholes y azúcares. Tesis doctoral. Universidad Complutense de Madrid 1992. ISBN: 978-84-8466-813-8
6. Beech, FW, Thomas S. Action antimicrobienne de l’anhydride sulfureux. Bull. l’O.I.V. 1985; 58: 564—581.
7. Bravo, E., Garcia E.M. Selección de microorganismos para la producción de vinos higiénicos. 1. Producción de sulfuro de hidrógeno e histamina durante la fermentación vínica. Alimentaria 1987; 103: 103—108.
8. Carmona Zubiri D·. Las minas de Hellín.Albacete 2014.http://dspace.umh.es/bitstream/11000/1519/2/azufre03%20primera%20parte.pdf http://dspace.umh.es/bitstream/11000/1519/3/azufre03%20segunda%20parte.pdf
9. Gallo Torres Tomás. Efectos nocivos del humo de la combustión sobre la salud y el medio ambiente. Diputación Provincial de Sevilla. Área Servicios Públicos Supramunicipales.2017.
10. Menzel DB, Keller DA, Leung KH. Covalent reactions in the toxicity of SO2 and sulfite .Adv Exp Med Biol. 1986; 197:477-92. doi: 10.1007/978-1-4684-5134-4_46.
11. Bold J. Considerations for the diagnosis and management of sulphite sensitivity. Gastroenterol Hepatol Bed Bench. 2012;5(1):3-6. PMID: 24834191; PMCID: PMC4017445.
MIGUEL POCOVÍ | Doctor en Ciencias y catedrático de Bioquímica y Biología Molecular



















